統合生理学HP https://yagita-lab.jp/
| 大学院科目名 | 統合生理学 | ||
| 医学部教室名 | 生理学教室(統合生理学部門) | ||
| スタッフ |
講師 小池 宣也 講師 土谷 佳樹 講師 梅村 康浩 |
||
| 研究内容 |
Principles and Human Physiology
〜概日リズムの原理からヒトの生理学、そして病態理解へ〜
生命と時間の不思議な関係。環境との関係性の中で成立した生命は、最も基本的な環境変化である地球の自転に伴う昼夜の日周変動への適応機構として、体内時計(概日時計)による生命機能の概日リズムを生み出しました。体内時計によって時間を細胞内に同化できたことで、秩序立った生命の営みをシステムとして世代を超えて受け継いでいくことが可能になったのです。時間は目に見えない実態のない(=物質ではない)概念的なものなのに、生物はそれを定量的な情報としてあらゆる生命活動に利用しているのです。「生物とは何か」という根源的な問いをも彷彿させる体内時計。一方で、環境時間と体内時計のズレは概日リズムを乱し、私たちの健康に様々な影響を及ぼすことが知られています。このような環境要因による疾患発症機構の理解にもつながる概日リズム研究は、「未病」の克服のカギとなる可能性があります。我々は、環境適応と時間情報を司る精巧かつ柔軟な概日リズムを統合的な学問体系として捉えることで原理解明と社会的課題の解決を目指します。
1)体内時計と概日リズム
地球の自転周期を計り、朝や夜が来ることを予測し、前もって生体機能を能動的に変化させることで環境変化に適応させるための生物装置。これが24時間周期の体内時計なのです。つまり、概日(おおよそ1日)時計とも呼ばれる体内時計の役割は、生体機能を地球の自転周期に伴う環境変化に同調適応させる「チューニング機構」です。例えば、ヒトにおいて体内時計は、睡眠リズムのみならず、自律神経系、内分泌系、循環器系、消化器系、免疫系など多くの生理機能を、それぞれに最適なタイミングで働くよう制御しています。このような生理機能の日周リズムを「概日リズム」と呼びます。私たちの研究室では、地球の運動の法則(宇宙の法則!)を生体内に取り込み同化させ、環境周期に様々な生命機能を適応させる「時間の情報化機構」としての体内時計。この体内時計とは、生物にとってどのような存在なのでしょうか?
私たちは、全身の細胞に備わる体内時計がES細胞やiPS細胞などの多能制幹細胞には存在せず、発生や細胞分化と共役して形成されていくことを明らかにしました。さらに、この体内時計の形成に伴って外界の環境リズム(母体のリズム)との同調適応が成立することを明らかにしました。これらの知見は、体内時計が外部環境と生体の内部環境をつなぐインターフェースであることを示唆しています。つまり、体内時計は、環境との関わりの中で生体内に時間秩序を創出する生理機能であり、生命のオペレーティングシステムと言える基本原理です。私たちは、体内時計の成立原理の理解から、分子・細胞・組織・臓器・個体レベルと階層を貫く動的恒常性の制御(概日リズム制御)メカニズムまで、環境適応の起源とも言える体内時計による生体制御システム解明を目指しています。
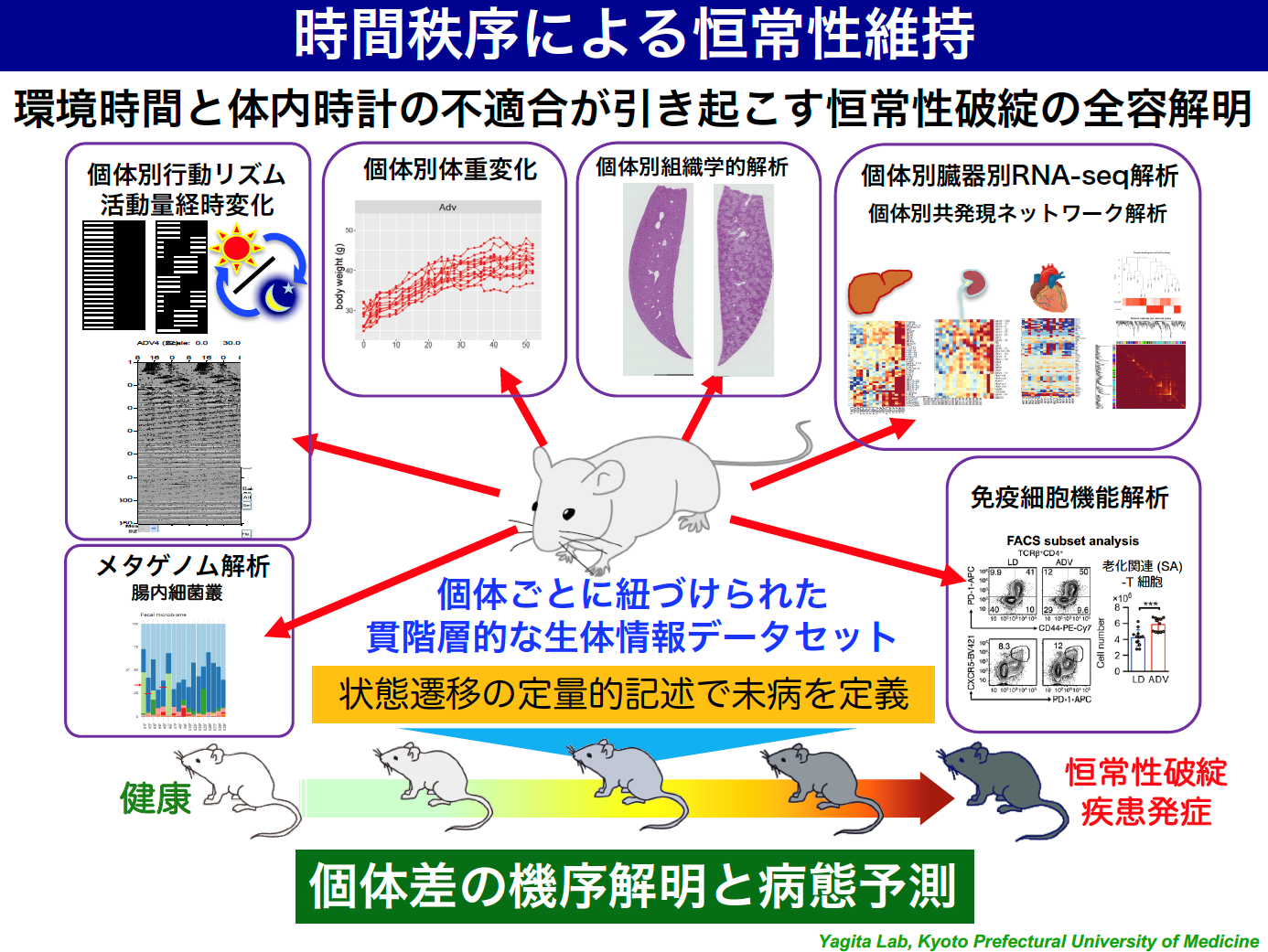
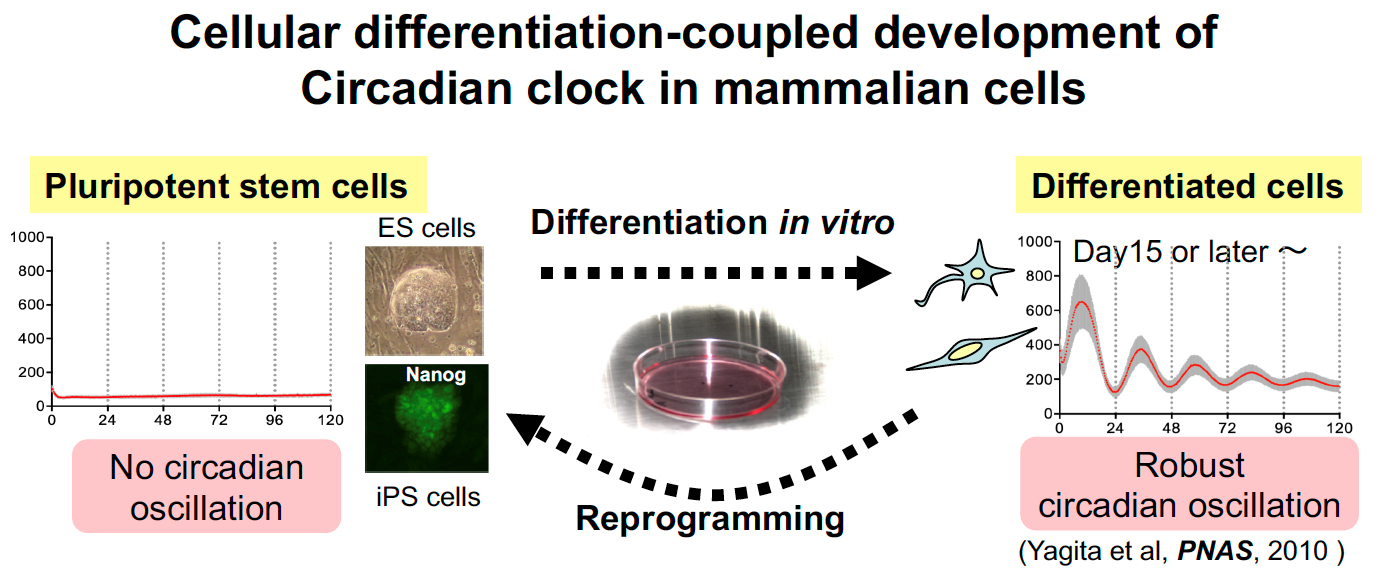 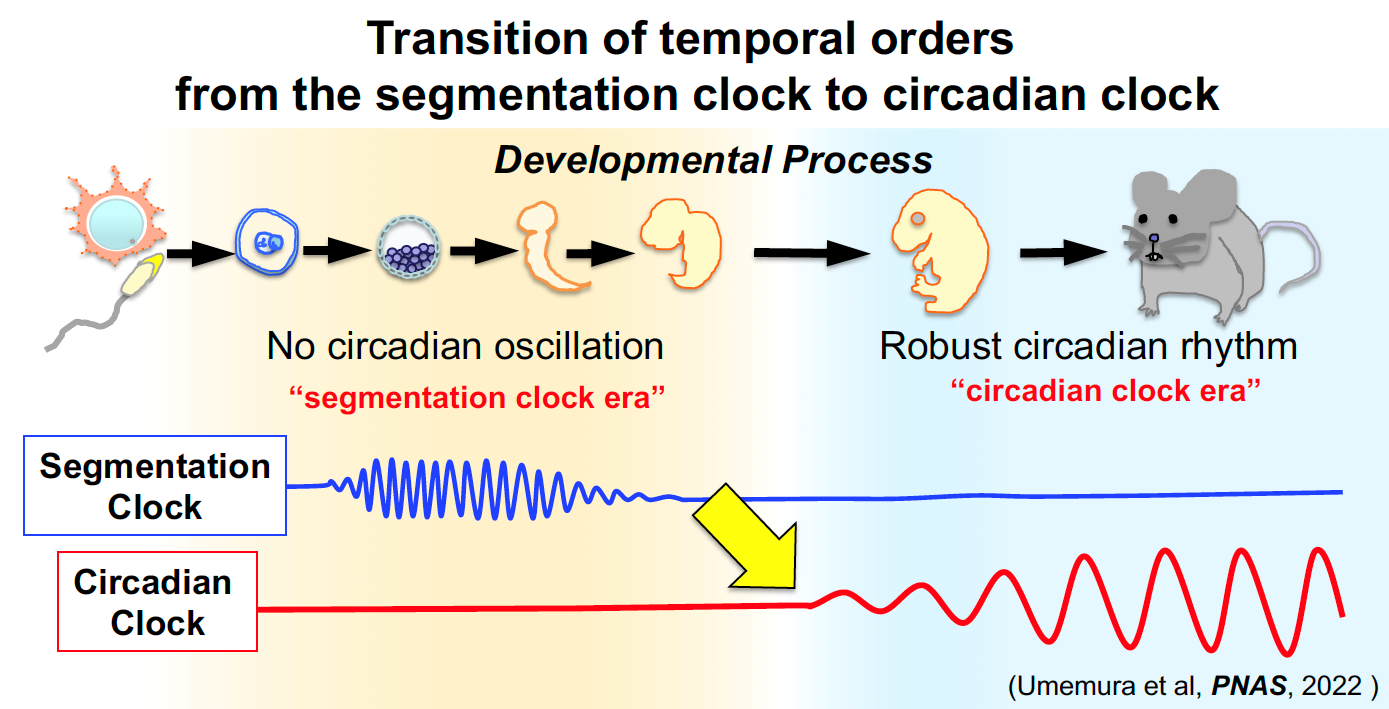 2)多因子疾患としての概日リズム障害
近年、グローバル化やIT化により都市機能の24時間化が進んでいます。深夜勤務を含む交替制勤務者(シフトワーカー)は増え続け、労働者人口の約3割に迫る1200万人以上が従事していると推定されています。また、夜中でも光に満ち溢れている街や、スマホやタブレットなどの普及で、ライフスタイルの変化は子どもたちにまで広がっています。このような24時間社会においては、規則正しい生活や早寝早起きといった、当たり前の生活環境を保つことも難しくなっているのではないでしょうか。このような現代社会の中で、本来、地球の自転周期へのチューニング機構として進化してきた「体内時計」と生活時間との「ズレ」は、様々な健康問題や疾患リスクの上昇につながっています。
しかし、単に「規則正しい生活をしましょう」「早寝早起きをしましょう」と言うだけでは全く問題の解決にはなりません。生活時間と体内時計のズレという「環境要因」が生体にどのように作用し組織細胞レベルの分子メカニズムの変容を引き起こすのか?環境要因による恒常性破綻メカニズムの研究は、「個人差」という大きな壁に阻まれ、現在はほとんど研究が進んでいない未開の原野です。私たちは、この困難な科学的「問い」に対し、様々な新しいアプローチで挑戦しています。私たちの研究室では、「環境適応」「未病」「個人差(個体差)」の原理解明を通して、現代の24時間社会における健康課題の解決を目指す「ヒトの生理学」を展開しています。
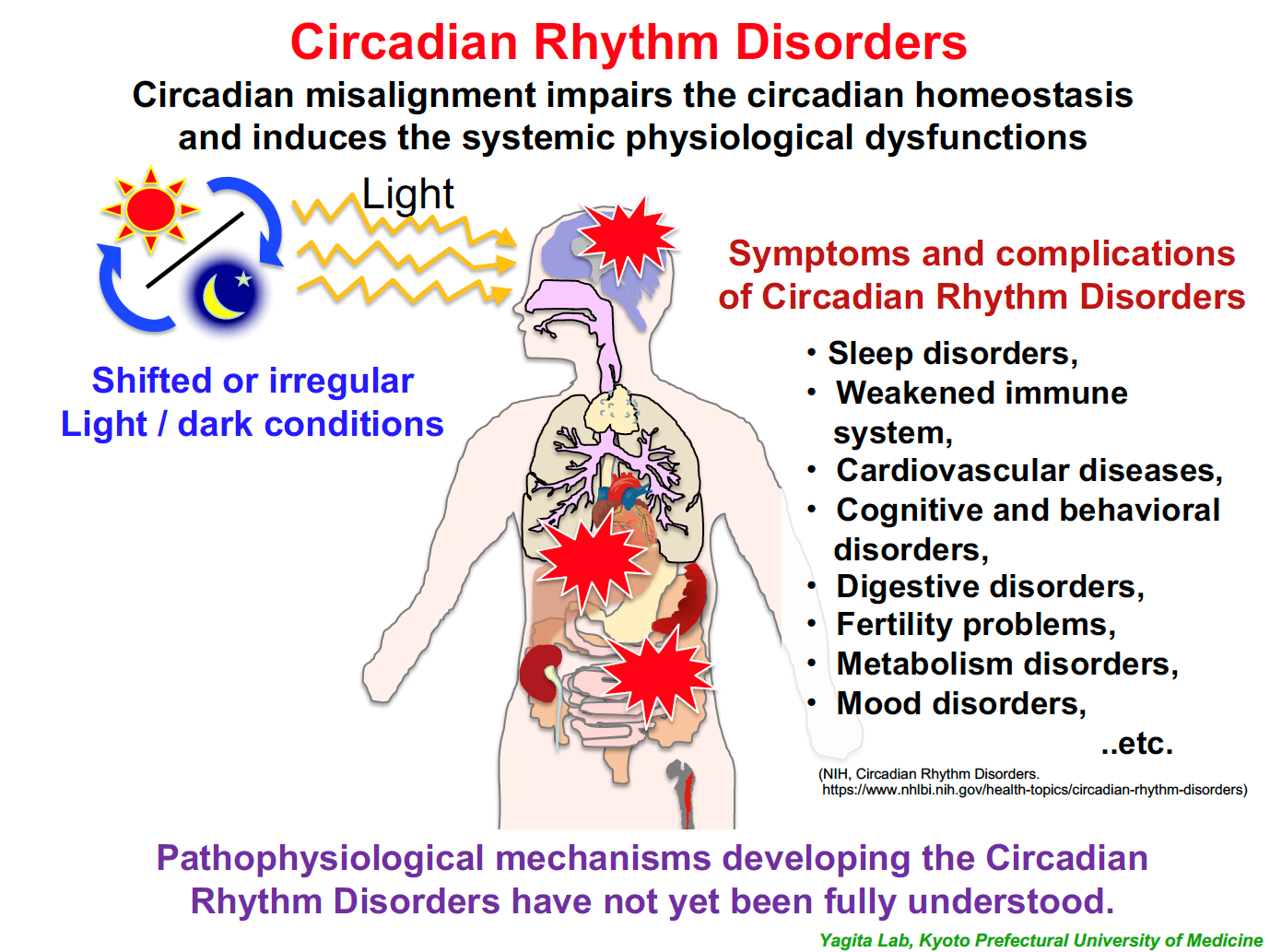 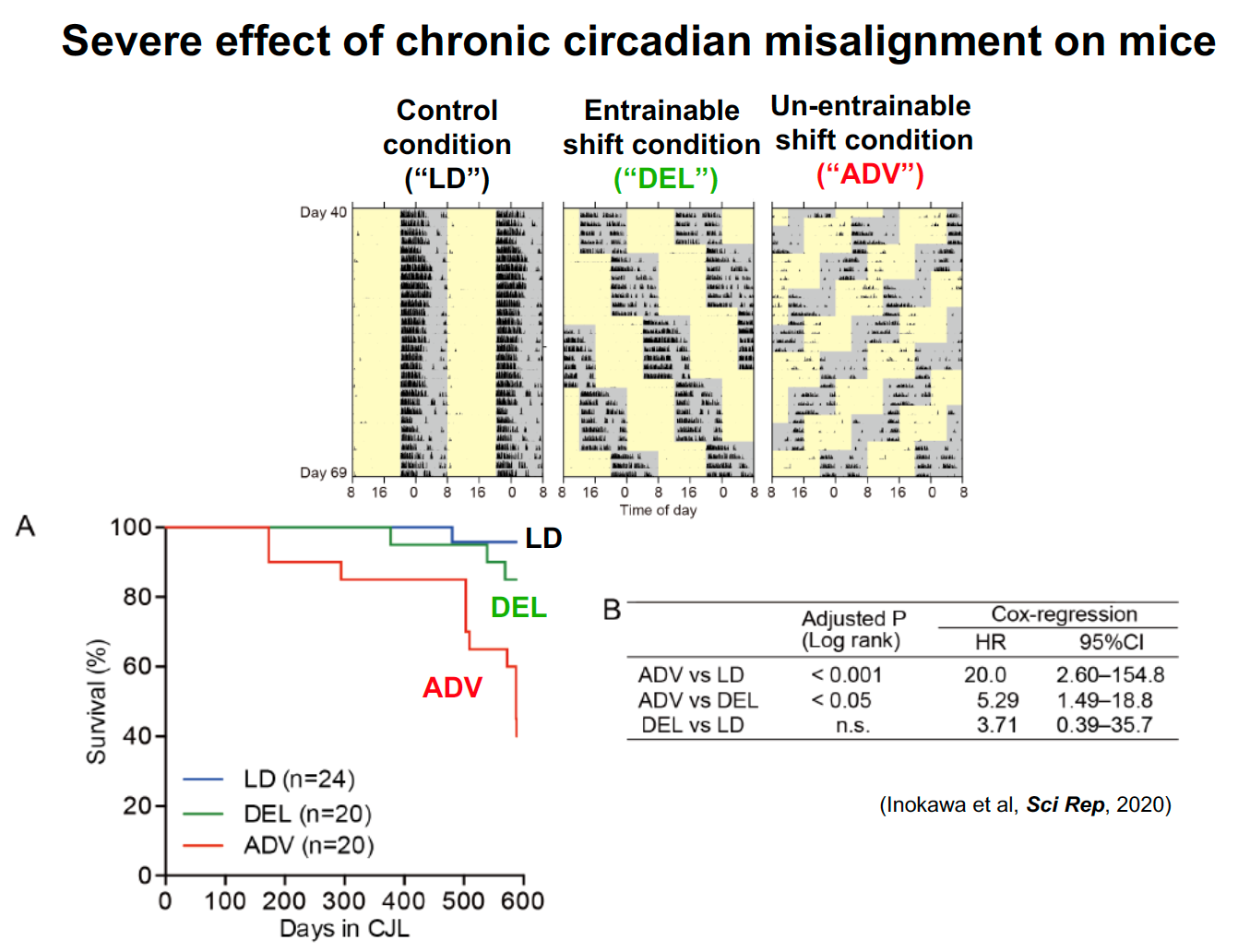  |
||
| 研究業績 |
|
||
| 問い合わせ先 |
TEL:075-251-5313 |
||
| 教室独自のHP |














